2017年国家医疗器械品质差事件监控监测年度报告详解
时间: 2024-05-12 15:32:51 | 作者: 医疗器械
根据“医疗器械监督管理条例”和“医疗器械品质差事件管理和评估办法(试行)”,国家食品药品监督管理局将组织对药品不良反应情况的监测以全面反映2017年中国医疗器械品质差事件监控监测情况。中心对2017年医疗器械品质差事件监控监测信息做综合分析总结,形成“医疗器械品质差事件监控监测年度报告2017)“并在此发布。
为全面反映2017年中国医疗器械品质差事件的监测情况,及时有效控制上市后医疗器械的风险,更好地保护公共设备的安全,原国家食品药品监督管理局组织国家中心不良药物反应监测编制“国家医疗器械品质差事件监控监测年度报告(2017)”。
2017年,全体医疗器械品质差事件监控监测人员牢固树立“四个意识”,认真贯彻“四个最严格的规定”,全面落实中央办公厅和国务院办公厅。设备创新理念,主动承担履行职责的责任,监督水平和能力逐步的提升。医疗器械品质差事件监测的重点慢慢地加强,工作动力慢慢地加强。不良事件的监测在监督医疗器械的整个生命周期中发挥着逐渐重要的作用。
2017年,在各级食品药监管理部门和医疗器械,用户,生产经营企业不良事件技术监督机构的共同努力下,医疗器械品质差事件监测稳步加快速度进行发展,总体风险状况稳定。公共安全使用机器发挥了积极的作用。同时,通过设立执照持有人建立医疗器械品质差事件直接报告制度,为进一步落实上市许可持有人在上市后风险管理中的主体责任奠定了基础。
2017年是对医疗器械品质差事件进行富有成效的监测的一年。就报告数量而言,医疗器械品质差事件报告数量超越37万份,人口报告数量达到282万份,报告数量大幅度的增加。从报告质量的角度看,通过关注医疗器械品质差事件报告的质量报告,报告质量逐步的提升;根据重点监测工作的有效性,重点监测“十三五”期间100种医疗器械类型在测量过程中取得了稳步进展,并在发现和控制上市后医疗器械风险方面发挥了非消极作用。举办第四届中国医疗器械风险管理论坛,推动行业和监督管理的机构医疗器械风险管理的意识和水平。
2017年,全国医疗器械品质差事件监控监测继续稳步推进。报告数量继续增加,报告质量逐步的提升,为上市后医疗器械风险分析评估提供有效数据支持。
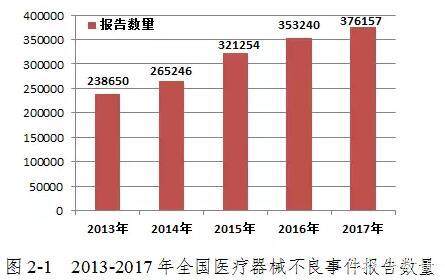
2017年,全国药品不良反应监测中心共收到376,157件医疗器械品质差事件报告,比2016年增加6.49%(图2-1)。
2017年,全国药品不良反应监测中心共收到211起可疑不良事件死亡报告和57754起严重不良反应事件报告,共计57965份,比2016年增加10.38%(图2-2)。 二零一七年死亡及重伤人士可疑不良事件报告数目占报告总数的15.41%,较二零一六年上升0.54%。
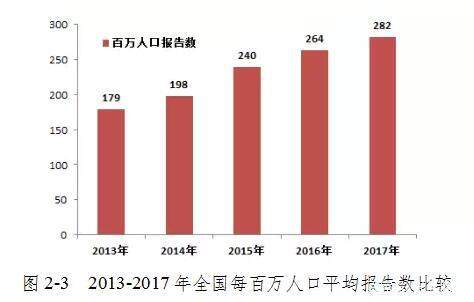
2017年,中国每百万人口中平均医疗器械品质差事件有282起,与2016年相比增加了18起(图2-3)。
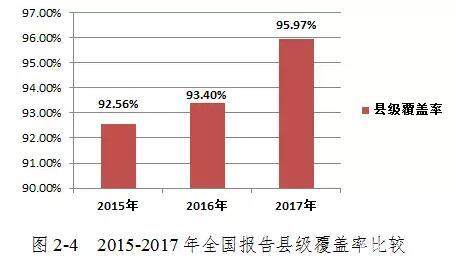
2017年,中国报告的医疗器械品质差事件县级覆盖率为95.97%,比2016年增加2.57%(图2-4)。
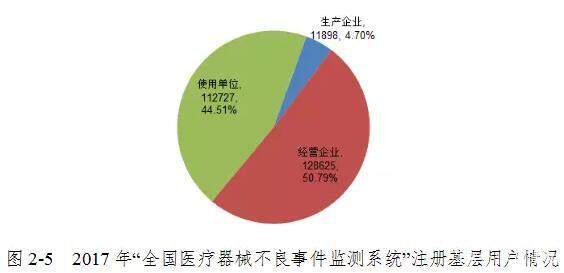
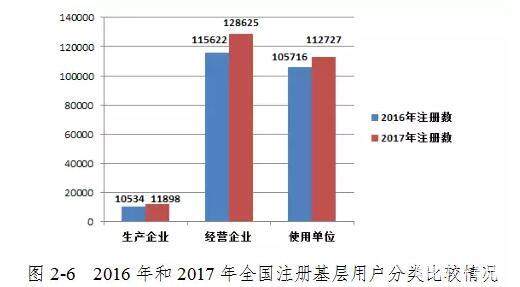
截至2017年12月31日,在“国家医疗器械品质差事件监控监测系统”中注册的基层用户(包括医疗器械制造商,运营公司和用户)共有253,250名。 其中,医疗器械生产企业11898家,占登记基层用户总数的4.70%; 营业企业128,625户,占登记基层用户的50.79%; 和112,727个用户,占注册基层用户的44.51%(图2-5)。
2017年,注册基层用户总数比2016年增长9.22%。其中,医疗器械制造商,运营公司和用户的注册基层用户分别增长了12.95%,11.25%和6.63% 与2016年相比(图2-6)。
2017年,全国共报告全国医疗器械事件326,622起,占报告总数的86.83%; 报告制造业企业865家,占报告总数的2.30%; 向运营公司报告了40,754份报告。 数量的10.83%; 个人报告120份,占报告总数的0.03%; 除此以外还有6个来源不明的报道(图3-1)。
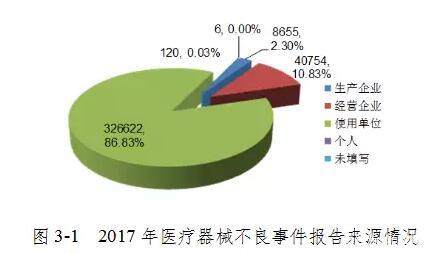
总体而言,不良事件报告仍大多数来源于单位使用,其次是经营公司。 生产企业提交报告的比例不足3%,不符合设备质量安全第一责任人的地位,履职意识有待提高。
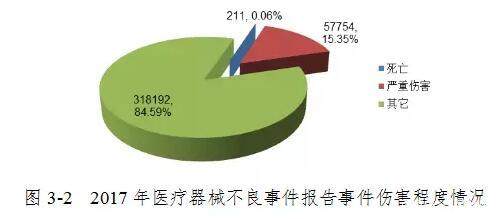
2017年全国医疗器械品质差事件报告中,共报告死亡211例,占报告总数的0.06%; 报告重伤57954例,占报告总数的15.35%; 报告的伤害报告共318,192份,占报告总数的84.59%(图3-2)。 2017年,不同程度损害报告的比例与2016年基本持平。
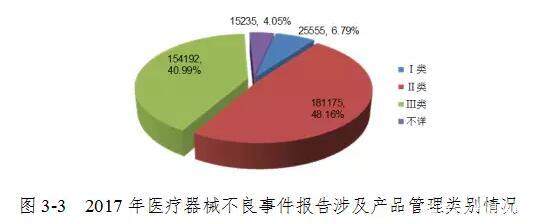
2017年,全国报告医疗器械品质差事件报告的第III类医疗器械154,192件,占总报告数的40.99%; 报告涉及II类医疗器械181,175份,占报告总数的48.16%。 有关一类医疗器械的报告数量为25555件,占报告总数的6.79%; 某些报告涵盖的设备管理类别未知,共计15235件,占报告总数的4.05%。 多个方面数据显示,大多数涉及III类和II类医疗器械的报告与医疗器械的风险程度一致(图3-3)。
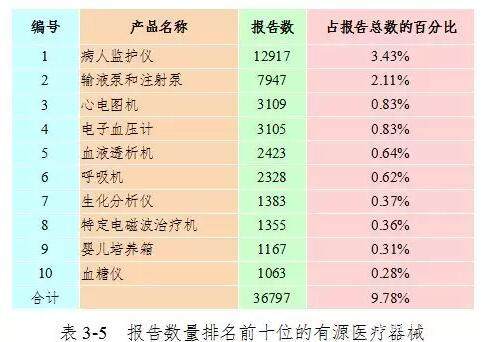
2017年,该国报告的医疗器械品质差事件中报告的前十名被动医疗器械是一次性输液器,一次性无菌注射器,静脉导管,子宫内器械和导管。 报告总数中有袋子,隐形眼镜,玻璃体温度计,导尿管,医用输液补片和一次性心电电极占35.89%。 详情请参阅表3-4。
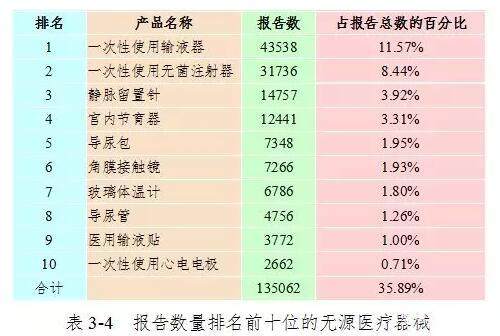
2017年,该国报告的医疗器械品质差事件报告中报告的十大主动医疗设施是患者监护仪,输液泵和注射泵,心电图仪,电子血压监测仪,血液透析机和呼吸机。 生化分析仪,专用电磁波治疗仪,婴幼儿培养箱,血糖仪占报告总数的9.78%。 详情信息请参见表3-5。
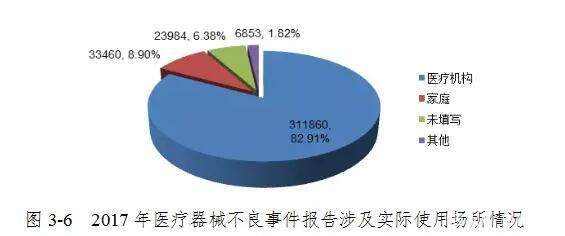
2017年,全国医疗器械品质差事件报告中,共使用“医疗机构”311860份,占82.91%; 使用“家庭”报告33,460份,占8.90%; 有报告6,853份,占1.82%,使用场所未使用报告23,984份,占6.38%(图3-6)。 使用该网站的复杂性是分析不良事件的原因时要考虑的因素之一。
2017年,全国共设立1431个监视哨点。进行了990次各种各样的形式的调查,组织了143次培训班,并以各种方式来进行了培训。共培训了9,577人次,确保监测点及时准确地报告不良事件。专家咨询会召开了97次。 562名参与者参与了这项调查。积极收集监测数据229万条,查阅文献3016条,懂产品的不良事件特征和可能原因。不良事件信息被广泛收集和分析。超过5万。各项工作稳步推进,为后期产品风险分析奠定了坚实基础。
2017年,国家监测不良药物反应中心发布了六期医疗器械警报,包括生物可吸收支架,除颤/监测系统,胰岛素笔注射器和植入式心脏复律除颤器。 32产品安全信息。
2017年,该报告的质量评估在全国各地得到了充分实施。各省中心根据全省工作和人员的真实的情况进行了地方评估。评估模型。评估报告的范围大多分布在在报告死亡和重伤情况,关键监测物种报告和辖区内生产企业的报告,有效地筛选监测数据中的重复报告和虚假报告,制定措施提高报告质量为设备风险挖掘提供较为可靠和可靠的信息。监测数据提高了各级审计人员对医疗器械品质差事件报告审核检查评估的意识,加强了国家,省,地市中心之间的沟通。
1.医疗器械:指直接或间接在人体上使用的仪器,设备,仪器,体外诊断,校准品,材料以及其他类似或相关物品,包括所需的计算机软件;它们的功用主要是通过物理手段等获得的,不是通过药理学,免疫学或代谢获得的,或者虽然涉及这一些方法但只起辅助作用;其目的是:
2.医疗器械品质差事件:指已经登记或已经备案的各类有害事件,合格的医疗器械,并在正常使用条件下发生,导致或可能对人体造成伤害。
根据医疗器械品质差事件造成的危害程度和发生原因,医疗器械生产企业应当在必要时采取警示,检查,修理,重新贴标签,修订手册,软件升级,更换,恢复,销毁和其他控制措施。
目前,中国医疗器械品质差事件监测的依据是“可疑报告”原则,收集报告,即报告可疑医疗器械品质差事件。
3.医疗设施不良事件监测:指发现,报告,调查,评估和控制医疗设备不良事件的过程。
5.死了可疑不良事件报告:是指患者最终死亡结果可疑医疗器械品质差事件报告。患者的死亡与使用医疗设施之间没明确的联系。
(1)医疗器械品质差事件主要是由于产品设计缺陷,注册验证不正确或不完善的使用说明书造成的,但产品质量合格。
(三)医疗事故是指医疗机构及其医务人员在医疗活动中违反医疗管理法律,行政法规,部门规章,护理规范和实务以及因疏忽造成人身伤害的事故。 (从原来的卫生部“医疗事故处理条例”)
